Nguyên tố Li là gì?
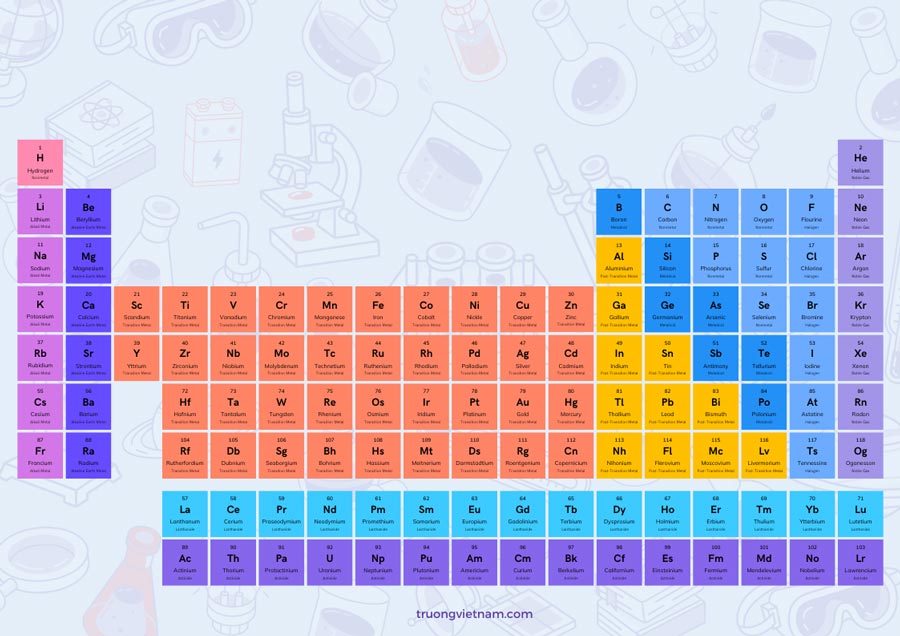
Nguyên tố Li trong hóa học là một nguyên tố hóa học có ký hiệu Li và số nguyên tử 3. Nguyên tố này thuộc nhóm 1 và chu kỳ 2 trong bảng tuần hoàn các nguyên tố. Nó có cấu trúc electron [He] 2s1 và là một kim loại kiềm. Trong điều kiện bình thường, nguyên tố Li là một kim loại mềm, trắng bạc và có tính chất hóa học khá tương tự như kim loại kiềm khác. Nguyên tố Li được tìm thấy trong tự nhiên trong dạng muối liên kết ion hòa tan trong nước.
| Ký hiệu hóa học: | Ký hiệu hóa học của nguyên tố Li là “Li”. |
| Tên Latin: | Tên Latin của nguyên tố Li là Lithium. |
| Số hiệu nguyên tử: | Số hiệu nguyên tử của nguyên tố Li là 3. |
| Chu kỳ: | trình bày, chu kỳ, nguyên tố, hóa học |
| Nhóm nguyên tố: | Li thuộc nhóm nguyên tố kiềm trong bảng tuần hoàn, thuộc nhóm IA.
Nhóm nguyên tố kiềm gồm 6 kim loại: Li (liti), Na (natri), K (kali), Rb (rubiđi), Cs (xiđi) và Fr (franci). Nhóm này có những đặc điểm chung trong hóa học như sau: 1. Loại nguyên tử: Nhóm nguyên tố kiềm có nguyên tử đơn giản, có một electron trên lớp vỏ ngoài cùng và phân lớp electron bằng 1s²2s¹. 2. Tính kim loại: Các nguyên tố kiềm đều là kim loại, có màu bạc, có ánh kim, dẫn điện và dẫn nhiệt tốt. 3. Tính chất hóa học: Các nguyên tố kiềm có tính chất hóa học khá giống nhau. Chúng dễ dàng cấp điện tử hóa trị, tạo ion dương và tạo hợp chất ion kiềm. Các ion kiềm thường có công thức M⁺, trong đó M là nguyên tố kiềm. Vì tính chất này, chúng có khả năng tạo liên kết ion với các nguyên tố phi kim để tạo ra các muối. 4. Tính khử mạnh: Do tính khử mạnh, các nguyên tố kiềm có khả năng khử các chất khác, khử nước và có thể cháy trong không khí. Đồng thời, vì tính chất dễ nhất bốc cháy, các nguyên tố kiềm cần được bảo quản trong dầu hoặc chất không cháy để tránh tiếp xúc với không khí hoặc nước. 5. Tính ăn mòn: Do tính chất ăn mòn cao của các ion kiềm, chúng có thể gây ăn mòn cho các chất liệu không bền như thủy tinh hoặc nhựa. 6. Độ hoà tan trong nước: Các ion kiềm có độ hoà tan cao trong nước, tạo thành dung dịch kiềm, có tính bazơ mạnh. Nhóm nguyên tố kiềm có các đặc điểm trên là do cấu trúc electron cùng nhóm, tạo nên các tính chất chung và tương tự nhau trong hóa học. |
| Khối lượng nguyên tử tương đối: | Khối lượng nguyên tử tương đối của nguyên tử Li là 6.94. |
| Số Oxy hóa: | Số oxy hóa của nguyên tố Li là +1. |
| Cấu hình electron (e): | Cấu hình electron của nguyên tử Li là 1s2 2s1. |
| Khối lượng riêng [g/cm3]: | Khối lượng riêng (density) của nguyên tố Li là khoảng 0,534 g/cm3. |
| Trạng thái: | Nguyên tố Li là nguyên tố hoá học có ký hiệu Li, số nguyên tử là 3 và có số hiệu nguyên tử là 6. Trong bảng tuần hoàn các nguyên tố, Li nằm ở nhóm 1 và chu kỳ 2.
Trạng thái tự nhiên của nguyên tố Li là chất rắn. Nó là kim loại kiềm mềm, có màu trắng, và có tính kim loại tốt. Một điểm đặc biệt của nguyên tử Li là nó có khả năng tạo ra hợp chất Li-ion. Các ion Li-ion là các cấu trúc có một điện tích dương và được sử dụng rộng rãi trong các ứng dụng pin lithium-ion, đèn sạc, và nhiều công nghệ điện tử khác. |
Tính chất hóa học của nguyên tố Li

Nguyên tố Li có các tính chất hóa học sau:
1. Nguyên tố Li có số hiệu nguyên tử là 3 và thuộc nhóm 1 trong bảng tuần hoàn, nên nó có một electron ở lớp ngoài cùng. Do đó, Li có cấu trúc electron 1s^2 2s^1.
2. Li là kim loại kiềm, nên nó có khả năng tạo ra ion dương Li+, bằng cách mất electron ở lớp ngoài cùng. Ion Li+ có cấu hình electron giống với heli (He).
3. Nguyên tố Li có tính khá mạnh trong việc tác động với nước, tạo ra dạng ion Li+ và tạo ra khí hiđro trong quá trình này.
4. Li có khả năng reagieren mit Stickstoff, um Lithiumazid (Li3N) zu bilden.
5. Li cũng có thể reagieren mit halogenen, um lithiumhalogenide zu bilden.
6. Li có khả năng kết hợp với oxy để tạo ra các hợp chất oxy hóa như oxit lithium (Li2O) và peroxyđi lithium (Li2O2).
7. Li có thể tác động với axit để tạo ra muối lithium, ví dụ như LiCl (muối lithium clorua) hoặc Li2SO4 (muối lithium sunfat).
8. Li có tính khá mạnh trong việc tạo phản ứng sinh nhiệt khi tiếp xúc với nước hoặc không khí.
Phản ứng của kim loại với nguyên tố Li
Phản ứng của kim loại với nguyên tố Li phụ thuộc vào loại kim loại đó. Với các kim loại như sắt (Fe), đồng (Cu) và kẽm (Zn), phản ứng sẽ xảy ra như sau:
1. Sắt (Fe):
– Phản ứng của Li với Fe sẽ tạo ra hợp chất LiFe. Công thức phản ứng có thể được biểu diễn bằng phương trình hóa học: 2Li + Fe -> LiFe
2. Đồng (Cu):
– Phản ứng của Li với Cu không xảy ra ở điều kiện phòng, tức là hai nguyên tố này không tác động lẫn nhau. Tuy nhiên, ở nhiệt độ cao, phản ứng có thể tạo ra hợp chất như LiCu.
3. Kẽm (Zn):
– Phản ứng của Li với Zn sẽ tạo ra hợp chất LiZn. Công thức phản ứng có thể được biểu diễn bằng phương trình hóa học: 2Li + Zn -> LiZn
Cần lưu ý rằng phản ứng của kim loại với nguyên tố Li có thể khác nhau tùy thuộc vào điều kiện thực hiện và các yếu tố khác nhau.

Phản ứng của phi kim với Li
Phản ứng của phi kim với nguyên tố Li phụ thuộc vào từng trường hợp cụ thể của phi kim và điều kiện phản ứng.
1. Với kim loại nhẹ: Một số kim loại nhẹ như nhôm (Al), kẽm (Zn), sắt (Fe) có thể phản ứng với nguyên tố Li. Trong trường hợp này, nguyên tố Li có thể trao đổi electron với kim loại nhẹ và tạo thành hợp chất LiAl, LiZn hoặc LiFe.
2. Với kim loại chuyển tiếp: Một số kim loại chuyển tiếp như đồng (Cu), bạc (Ag), vàng (Au) không phản ứng trực tiếp với Li vì tính bền của mạng tinh thể kim loại. Tuy nhiên, trong điều kiện phù hợp, như sử dụng các chất chứa oxi hoặc các chất xúc tác, phản ứng có thể xảy ra với sự tạo thành muối Li.
3. Với phi kim: Phi kim là các nguyên tố không kim như Carbon (C), nitơ (N), oxy (O), lưu huỳnh (S) không thể phản ứng trực tiếp với nguyên tố Li vì không có khả năng trao đổi electron. Tuy nhiên, trong điều kiện phản ứng đặc biệt, như sử dụng phương pháp điện hóa hoặc các chất xúc tác, phản ứng có thể xảy ra và tạo thành hợp chất Li.
Phản ứng của Oxit Kim loại với Li
Phản ứng giữa oxit kim loại và nguyên tố Li là một phản ứng oxi-hoá khử. Trong phản ứng này, oxit kim loại bị khử thành kim loại và nguyên tố Li bị oxi hóa thành ion Li+.
Chẳng hạn, phản ứng giữa oxit nhôm (Al2O3) và lithium (Li) là:
2 Al2O3 + 6 Li -> 4 Al + 3 Li2O
Trong phản ứng này, từ 6 phân tử Li, 3 phân tử oxi trong oxit nhôm bị thu hồi thành ion oxi trong Li2O. Đồng thời, 2 phân tử Al trong oxit nhôm bị khử thành kim loại Al.
Phản ứng này diễn ra một cách mạnh mẽ và gây ra sự tạo ra nhiệt và nhiều khí.
Phản ứng Oxi với Li
Phản ứng oxi với nguyên tử Li sẽ tạo thành hợp chất oxit của Li, hay còn gọi là Li2O.
2Li + O2 → Li2O
Trong phản ứng này, mỗi nguyên tử Li kết hợp với một phân tử O2 để tạo ra một phân tử Li2O.
Tính chất vật lý của Li
Nguyên tố Li (liti) có các tính chất vật lý như sau:
1. Tên nguyên tố: Liti
2. Ký hiệu hóa học: Li
3. Số nguyên tử: 3 (Li có 3 proton trong hạt nhân)
4. Khối lượng nguyên tử: 6,941 amu (atomic mass unit)
5. Thể hiện trong bảng tuần hoàn: Li (thuộc hàng 1, cột 1)
6. Giai đoạn trong hệ thống kiểu mạng của nguyên tố: kim loại kiềm
7. Tính chất kim loại: Li là một kim loại nhẹ, mềm và có màu trắng bạc.
8. Nhiệt độ nóng chảy: 180,54°C (453,69 K)
9. Nhiệt độ sôi: 1342°C (1615,15 K)
10. Mật độ: 0,534 g/cm³
11. Cấu trúc tinh thể: tinh thể vô định hình (hình thoi, gần như cấu trúc cửu tạp)
12. Điểm nút (điểm L): -61,83°C (-79,31°F)
13. Điểm sôi: 1347°C (2456°F)
14. Hóa trị: Li có hóa trị +1, thường có kí hiệu Li+.
Điều chế Li trong phòng thí nghiệm
Nguyên tố Lithium (Li) được điều chế trong phòng thí nghiệm thông qua quá trình khử hợp chất Lithium có mặt trong các nguyên liệu như muối lithium carbonate (Li2CO3) hay kim loại lithium từ đường điện ly.

Một phương pháp điển hình để điều chế nguyên tố Li là thông qua quá trình điện phân chất Lithium chloride (LiCl) trong dung dịch. Trong quá trình này, dung dịch LiCl sẽ được chứa trong một bể điện phân, chia thành hai phần bằng màng ngăn cách (membrane). Một cực âm (âm điện cực) được đặt ở phía anốt (phần chứa ion Cl-) và một cực dương (dương điện cực) ở phía katot (phần chứa ion Li+). Khi áp dụng điện áp lên hệ thống, các ion Li+ sẽ di chuyển thông qua màng ngăn cách và định cực dương, tạo thành lớp kim loại lithium ở bề mặt katot.
Quá trình trên được điều khiển kỹ thuật để đảm bảo hiệu suất điện phân cao và nguyên tố Li thu được là đủ sạch và nguyên chất. Sau đó, nguyên tố Li có thể được cô quay, rửa sạch và đóng gói để được sử dụng hoặc lưu trữ trong các ứng dụng khác nhau.
Điều chế Li trong công nghiệp
Nguyên tố Li (lithium) là một kim loại kiềm nhẹ, thường tồn tại dưới dạng muối trong thiên nhiên. Việc điều chế nguyên tố Li trong công nghiệp thường được thực hiện thông qua quá trình điện phân muối. Dưới đây là một phương pháp phổ biến để điều chế nguyên tố Li:
1. Khai thác quặng lithi: Lithi tự nhiên thường được tìm thấy trong quặng spodumene, lepidolite và pegmatite. Quá trình khai thác quặng lithi bao gồm việc nhổ quặng và xử lý để tách lithi từ các tạp chất khác.
2. Quá trình chế biến: Quặng lithi sau khi được khai thác được xử lý để tách kim loại lithi từ các tạp chất. Các phương pháp chế biến bao gồm nghiền nát, lắng khuẩn, và phản ứng hóa học để tách riêng kim loại lithi.
3. Tạo muối lithium: Sau quá trình chế biến, kim loại lithium được chuyển đổi thành muối lithium, thường là lithium carbonate (Li2CO3) hoặc lithium hydroxide (LiOH), để thuận tiện cho việc vận chuyển và sử dụng.
4. Quá trình điện phân: Muối lithium được hòa tan trong nước để tạo thành dung dịch chứa lithium. Dung dịch này sau đó được đưa vào một cấu trúc điện phân, trong đó nhúng hai điện cực. Dưới tác động của dòng điện, ion lithium tách ra khỏi dung dịch và thu lại ở điện cực âm, trong khi các ion khác bị chặn lại.
5. Tinh luyện và làm sạch: Sau quá trình điện phân, nguyên tố lithium thu được cần được tinh luyện và làm sạch để đạt được mức độ tinh khiết mong muốn. Các phương pháp tinh luyện bao gồm nung chảy và điện phân tiếp theo.
Cuối cùng, nguyên tố Lithium được thu thập và đóng gói để sử dụng trong các ứng dụng công nghiệp như pin lithium-ion, đèn ống màu, hợp chất lithium và những ứng dụng khác.
Ứng dụng của Li trong cuộc sống
Nguyên tố Li, còn được gọi là lithium, có nhiều ứng dụng trong cuộc sống hàng ngày và các ngành công nghiệp. Dưới đây là một số ứng dụng phổ biến của nguyên tố Li:
1. Pin lithium-ion: Pin lithium-ion được sử dụng rộng rãi trong các thiết bị di động như điện thoại, máy tính bảng, máy tính xách tay và đồng hồ thông minh. Pin lithium-ion có khả năng lưu trữ năng lượng cao, dễ sử dụng và có tuổi thọ tương đối dài.
2. Hợp kim lithium: Li được sử dụng để làm thành phần hợp kim trong nhiều ứng dụng, bao gồm sản xuất pin, máy bay không người lái, các thiết bị điện tử, vật liệu chống oxy hóa và các thiết bị y tế.
3. Thuốc an thần: Một dạng muối lithium, được gọi là carbonate lithium, được sử dụng trong việc điều trị các rối loạn tâm lý như trầm cảm và rối loạn tâm thần mani-depressive (bipolar disorder). Nguyên tố Li có khả năng ổn định tâm trạng và giảm các triệu chứng của các bệnh này.
4. Đóng gói chất kết dính: Lithium stearate, một hợp chất có chứa lithium, được sử dụng trong ngành sản xuất đóng gói chất kết dính. Nó giúp tạo màng bảo vệ trên các bề mặt kim loại và làm cho chúng chống nước và chống ma sát.
5. Nhiên liệu hạt nhân: Li-6 và tritiu (H-3), cả hai đều là isotop của nguyên tố Li, được sử dụng trong các ứng dụng năng lượng hạt nhân, chẳng hạn như trong các loại pin hạt nhân.
6. Đèn natri: Ở dạng muối, nguyên tố Li được sử dụng để tạo ánh sáng trong đèn natri cao áp. Đèn này được sử dụng rộng rãi trong đèn đường, chiếu sáng công cộng và chiếu sáng trong các ngành công nghiệp.
Như vậy, nguyên tố Li có nhiều ứng dụng đa dạng trong cuộc sống hàng ngày và các ngành công nghiệp khác nhau.
Những điều cần lưu ý về nguyên tố Li
Nguyên tố Li là nguyên tố hóa học có ký hiệu Li và số nguyên tử 3 trong bảng tuần hoàn. Dưới đây là những điều cần lưu ý về nguyên tố Li:
1. Tính chất hóa học: Li là kim loại kiềm thứ nhất trong bảng tuần hoàn. Nó có tính kiềm mạnh và dễ tạo ion Li+ trong các phản ứng hóa học. Nguyên tử Li có khả năng mất một điện tử để trở thành ion Li+, tạo ra 2 electron valence duy nhất.
2. Tính chất vật lý: Li là kim loại nhẹ, có màu trắng bạc, và có một điểm nóng chảy thấp ở khoảng 180°C. Nó cũng là một chất phản ứng kém với nhiệt và không dẫn điện tốt.
3. Từ nguyên và nguồn gốc: Tên gọi “lithium” xuất phát từ từ tiếng Hy Lạp “lithos”, có nghĩa là “đá”. Đây là do Li có khả năng tạo hợp chất với các nguyên tố đá như oxygen và nitrogen.
4. Sử dụng: Nguyên tử Li được sử dụng rộng rãi trong các ứng dụng công nghiệp và công nghệ. Một ứng dụng quan trọng của nó là trong pin lithium-ion, một loại pin sạc lại được sử dụng rộng rãi trong các thiết bị điện tử và xe điện. Ngoài ra, Li cũng được sử dụng trong xử lý kim loại như là một chất trung gian trong quá trình sản xuất từ nhôm.
5. Tài nguyên và quặng: Li không phải là nguyên tố phổ biến trong vỏ Trái Đất. Các nguồn tài nguyên chính của nó là quặng spodumene, lepidolite và petalite. Hiện nay, việc khai thác và sản xuất Li đang trở nên ngày càng quan trọng để đáp ứng nhu cầu ngày càng tăng về pin lithium-ion.
6. Tác động đến môi trường: Bột Li và hợp chất Li có thể gây cháy hoặc phản ứng gắt với nước, tạo ra khí hydro và có thể gây cháy. Vì vậy, việc xử lý và vận chuyển Li phải được thực hiện cẩn thận để tránh tai nạn môi trường.