Nguyên tố Sb là gì?
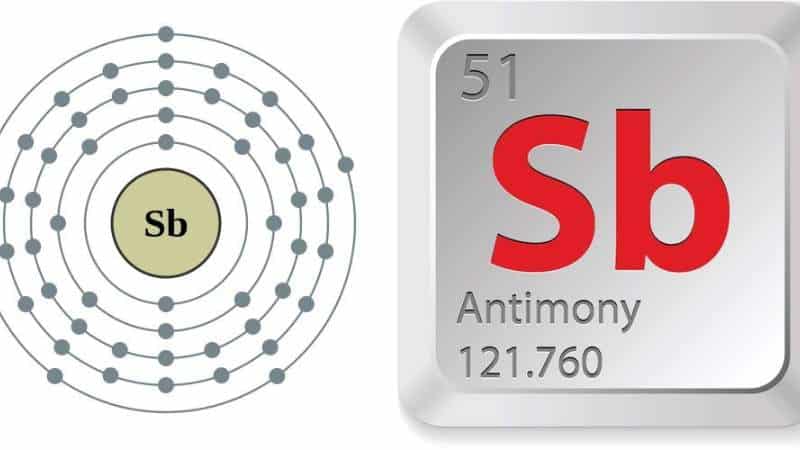
Nguyên tố Sb trong hóa học là Antimon.
| Ký hiệu hóa học: | Ký hiệu hóa học của nguyên tố Antimon là Sb. |
| Tên Latin: | Tên Latin của nguyên tố Sb là Antimonium. |
| Số hiệu nguyên tử: | Số hiệu nguyên tử của nguyên tố Sb là 51. |
| Chu kỳ: | Chu kỳ nguyên tố hóa học là một khái niệm trong hóa học dùng để mô tả sự sắp xếp các nguyên tố hóa học trên bảng tuần hoàn. Trên bảng tuần hoàn, từ trái qua phải, các nguyên tố được sắp xếp theo thứ tự tăng dần của số nguyên tử. Các nguyên tố trong cùng một chu kỳ có cùng số lượng lớp điện tử. Ví dụ: Be (nguyên tố lần thứ 4 trên bảng tuần hoàn) có cấu trúc electron là 1s2 2s2. Chu kỳ 3: Bao gồm các nguyên tử từ Na đến Ar. Mỗi nguyên tử trong chu kỳ này có 3 lớp điện tử. Ví dụ: Cl (nguyên tố lần thứ 17 trên bảng tuần hoàn) có cấu trúc electron là 1s2 2s2 2p6 3s2 3p5. |
| Nhóm nguyên tố: | Sb thuộc nhóm nguyên tố pnưonic (pnêuônic) trong bảng tuần hoàn các nguyên tố hóa học. Nhóm nguyên tố pnưonic được gọi là nhóm chalcogen, còn có tên khác là nhóm 16 hoặc nhóm VIA. Nhóm được đặc biệt trong hóa học vì có các đặc điểm sau: 1. Nguyên tố pnưonic là nhóm chỉ có 3 nguyên tố (O, S, Se, Te, và Po) trong bảng tuần hoàn, với O và S là hai nguyên tố phổ biến nhất. Nhóm còn có một số isotop không tự nhiên và một số nguyên tố nhân tạo. 2. Các nguyên tố pnưonic đều có hóa trị -2, nghĩa là chúng có xu hướng nhận 2 điện tử để đạt được cấu hình electron bền nhất là cấu hình của khí noble gần nhất. Như vậy, các nguyên tố pnưonic thường tạo thành các ion âm có công thức R2- (với R là nguyên tố pnưonic). 3. Nguyên tố pnưonic có tính chất hóa học khá phổ biến và đa dạng. Ví dụ, nguyên tố O và S phản ứng mạnh với các kim loại để tạo thành muối. Chúng cũng có khả năng oxi hóa các nguyên tố khác trong phần lớn các hợp chất hóa học. 4. Một số chất chứa nguyên tố pnưonic, như axit sulfuric và axit phosphoric, có ứng dụng quan trọng trong công nghiệp và trong ngành y học. 5. Các nguyên tố pnưonic có tính chất chalcophilic, có nghĩa là chúng có xu hướng tương tác với các nguyên tố kim loại để tạo thành các hợp chất hợp kim. |
| Khối lượng nguyên tử tương đối: | Khối lượng nguyên tử tương đối (AN) của nguyên tố Sb (Antimon) là 121,76. |
| Số Oxy hóa: | Số oxi hoá của nguyên tố Sb (stibi, antimon) có thể thay đổi từ -3 đến +5. |
| Cấu hình electron (e): | Cấu hình electron của nguyên tố Sb (stibi, có tên khác là antimony) là: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p3. Điều này có nghĩa là Sb có 51 electron. Sb có 5 lớp electron, từ lớp 1 đến lớp 5. Lớp đầu tiên có 2 electron, lớp thứ hai có 8 electron, lớp thứ ba có 18 electron, lớp thứ tư có 18 electron và lớp thứ năm có 5 electron. Sb có 3 electron ở lớp valence (lớp ngoài cùng), đó là các electron trong cấu hình 5s2 5p3. Electron trong lớp valence là các electron tham gia vào liên kết hoá học và tạo thành các liên kết hóa học. |
| Khối lượng riêng [g/cm3]: | Khối lượng riêng của nguyên tố Sb là khoảng 6,697 g/cm3. |
| Trạng thái: | Nguyên tố Sb có trạng thái tự nhiên là rắn. Điểm đặc biệt của nguyên tố này là nó có màu trắng bạc và là một nhà phân cực mạnh. Sb cũng là một trong những nguyên tố tự nhiên ít phổ biến và được tìm thấy chủ yếu trong khoáng chất chứa chì sulfua và antimoni. |
Tính chất hóa học của nguyên tố Sb
Nguyên tử số: 51
Nguyên tử khối: 121,76 g/mol
Tính chất vật lý:
– Nguyên tố Sb là một kim loại màu trắng bạc
– Nó có một điểm nóng chảy kỳ lạ 630,76 °C (1167,37 °F)
– Tơ tơ khối (density) của nó là 6,68 g/cm3
Tính chất hóa học:
– Antimon có thể phản ứng với axit để tạo ra khí antimon trihydrit (SbH3) có mùi khai hôi và độc.
– Nó cũng có thể phản ứng với halogen (F, Cl, Br, I) để tạo ra các hợp chất antimon halide (SbX3) với cấu trúc tinh thể đơn giản.
– Trong môi trường oxi, antimon cháy mạnh và tạo ra oxit antimon pentaoxit (Sb2O5).
Ngoài ra, antimon cũng có thể tạo ra các hợp chất hóa học khác như trisulfua antimon (Sb2S3) và antimonit (Sb2O3).
Phản ứng của kim loại với Sb
Kim loại phản ứng với nguyên tố Sb (stibi) tạo ra hợp chất antimon. Có thể xảy ra nhiều phản ứng khác nhau giữa kim loại và nguyên tố Sb tuỳ thuộc vào điều kiện phản ứng và loại kim loại được sử dụng.
Ví dụ: Khi kim loại nhôm (Al) tiếp xúc với Sb, phản ứng sẽ tạo ra hợp chất AlSb (nhôm antimonit):
2Al + 3Sb -> Al2Sb3
Phản ứng này còn được gọi là phản ứng hợp lưu huỳnh giữa Al và Sb.
Phản ứng của phi kim với Sb
Phản ứng của phi kim (nonmetal) với nguyên tố Sb (stibium) có thể là phản ứng oxi hóa – khử hoặc phản ứng tạo liên kết hóa học.
Phản ứng oxi hóa – khử:
1. Phản ứng cháy: Khi phi kim phản ứng với khí oxy (O2), có thể xảy ra phản ứng cháy để tạo ra oxit của phi kim đó và sinh ra nhiệt và ánh sáng. Ví dụ, nguyên tố lưu huỳnh (S) có thể cháy trong không khí tạo ra khí lưu huỳnh đioxit (SO2).
2. Phản ứng khử: Phi kim cũng có thể là chất khử. Khi phản ứng với một chất có khả năng oxi hóa, phi kim sẽ cung cấp electron để khử chất đó. Ví dụ, nguyên tố bor (B) có thể khử khí clor (Cl2) để tạo ra bor clorua (BCl3).
Phản ứng tạo liên kết hóa học:
Phi kim cũng có thể tham gia vào các phản ứng tạo liên kết hóa học để tạo ra các hợp chất mới. Ví dụ, nguyên tố lưu huỳnh có thể tạo liên kết với nguyên tố thủy (H) để tạo ra hợp chất lưu huỳnh nhiễu (H2S).
Phản ứng của Oxit Kim loại với Sb
Phản ứng giữa oxit kim loại và nguyên tố Sb (Antimony) có thể xảy ra theo các phản ứng sau:
1. Oxit Sb2O3 + kim loại nóng = Sb + Kim loại oxit
Phản ứng này xảy ra khi oxit antimony(III) (Sb2O3) được đốt cháy trong môi trường nhiệt độ cao với kim loại, ví dụ như Mg hoặc Al. Kết quả là antimony sẽ được giải phóng và hợp thành trong kim loại oxit.
2. Oxit Sb2O5 + kim loại = Sb + Kim loại oxit
Tương tự, antimony pentoxide (Sb2O5) có thể phản ứng với kim loại để tạo thành antimony và oxit kim loại tương ứng.
3. Oxit Sb2O4 (gọi là anhydrit Sb2O4) + H2 = Sb + H2O
Phản ứng này xảy ra khi anhydrit antimony(IV) oxide (Sb2O4) tác dụng với hydro. Kết quả là antimony và nước được tạo ra.
Các phản ứng trên chỉ là một số ví dụ và có thể có các phản ứng khác phụ thuộc vào điều kiện và môi trường phản ứng.
Phản ứng Oxi với Sb
Phản ứng của oxi với nguyên tố Sb (stibi) sẽ tạo ra hợp chất oxit của stibi. Phản ứng có thể được biểu diễn như sau:
2Sb + 3O2 → 2Sb2O3
Trong phản ứng này, nguyên tố Sb oxi hóa từ trạng thái 0 lên trạng thái +3 trong oxit Sb2O3.
Tính chất vật lý của nguyên tố Sb
Nguyên tố Sb có số nguyên tử là 51, thuộc nhóm 15 trong bảng tuần hoàn và có ký hiệu hóa học là Sb. Dưới đây là một số tính chất vật lý cơ bản của nguyên tố Sb:
1. Loại: Sb là một chất bán kim loại, nằm giữa kim loại và bán dẫn trong dãy phân nhóm p.
2. Màu sắc: Sb có màu trắng bạc với một chút màu vàng hoặc xám.
3. Trạng thái: Trong điều kiện phổ biến, Sb tồn tại ở trạng thái rắn.
4. Điểm nóng chảy: Điểm nóng chảy của Sb là 630,63°C.
5. Điểm sôi: Điểm sôi của Sb là 1587°C.
6. Mật độ: Mật độ của Sb là 6,691 g/cm3.
7. Độ dẫn điện: Sb là một chất bán dẫn, có khả năng dẫn điện nhưng ít dẫn điện hơn kim loại thật sự.
8. Tính ôxi hóa: Sb có thể tạo ra các hợp chất ôxi hóa như SbO2, Sb2O3 và SbO.
9. Điện tích không gian: Sb có điện tích không gian là 4.
10. Cấu trúc tinh thể: Sb có cấu trúc tinh thể là hexagonal.
Đây chỉ là một số tính chất vật lý cơ bản của nguyên tố Sb và vẫn còn nhiều tính chất khác chưa được đề cập.

Điều chế Sb trong phòng thí nghiệm
Điều chế nguyên tố Sb (Chì) trong phòng thí nghiệm có thể được thực hiện theo các bước sau:
1. Chuẩn bị các vật liệu: Cần chuẩn bị chất đầu vào là antimonit (Sb2S3) hoặc antimonit poman (Sb2S3.nH2O). Ngoài ra, cần có oxi (O2) là chất oxy hóa và chất khử như coke (C) hoặc than cốc (anthracite C) để thực hiện quá trình khử.
2. Tiến hành quá trình khử: Đặt chất antimonit (Sb2S3) hoặc antimonit poman (Sb2S3.nH2O) cùng với chất khử (coke hoặc than cốc) trong một ống chứa có lúc cách mài tạo điều kiện oxy hóa và khử diễn ra. Sử dụng lửa mạnh hoặc tùy theo quy trình đặt nhiệt nóng chảy cho chất liệu.
3. Lọc chất sản phẩm: Sau khi quá trình khử hoàn thành, thu được sản phẩm là chì nóng chảy, cần lọc chất lỏng này bằng các phương pháp như sử dụng một cái lưới lọc hay màng lọc để tách chì rắn khỏi dung dịch còn lại.
4. Xử lý và tinh chế: Chì thu được sau lọc có thể chứa các tạp chất khác, cần xử lý và tinh chế nó để loại bỏ những tạp chất không mong muốn. Quy trình xử lý này bao gồm nhiều bước như tái phản ứng, đồng kết tủa, tạo lớp phủ, hoặc sử dụng các phương pháp nhiệt độ cao để tách chì tinh khiết từ một pha khác.
5. Kiểm tra và chuẩn độ: Khi đã tinh chế chì, cần kiểm tra chất lượng và tiến hành các bước chuẩn độ để xác định hàm lượng chì trong mẫu.
Lưu ý: Các quy trình điều chế chì có thể có sự khác biệt tùy thuộc vào các tài liệu, thiết bị và quy trình được sử dụng trong phòng thí nghiệm cụ thể. Việc thực hiện quá trình như trên trong một môi trường an toàn và tuân thủ các quy định về an toàn lao động là rất quan trọng.
Điều chế Sb trong công nghiệp
Nguyên tố Sb, hay còn được gọi là Antimon, có thể được điều chế trong công nghiệp thông qua các phương pháp sau:
1. Phương pháp đốt cháy: Nguyên liệu chính để điều chế Sb bằng phương pháp này là antimonite (Sb2S3). Quá trình bắt đầu bằng việc phản ứng antimonite với khí oxi trong môi trường nhiệt độ cao để tạo thành Sb2O4. Sau đó, Sb2O4 sẽ được khử bằng cacbon hoặc than để tạo ra antimon kim loại.
2. Tinh chế từ quặng: Sb cũng có thể được tách ra từ quặng antimon chứa Sb2S3 thông qua quá trình nấu luyện. Quặng được nghiền và nung trong không khí để tạo thành oxit Sb2O4. Sau đó, Sb2O4 sẽ được khử bằng cacbon hoặc than trong lò luyện để thu được antimon kim loại.
3. Phương pháp điện phân: Antimon có thể được điều chế bằng cách đẩy điện từ dung dịch chứa muối Sb3+, chẳng hạn như sunfat antimon (Sb2(SO4)3) hoặc cloantimonit (Sb3Cl3). Quá trình này liên quan đến đặt các điện cực và chạy dòng điện qua dung dịch để tạo ra kim loại antimon.
Sau khi điều chế, antimon có thể được sử dụng trong nhiều ứng dụng công nghiệp khác nhau, bao gồm sản xuất hợp kim, pin, chất chống cháy, máy tính, và các ứng dụng trong ngành dược phẩm.
Ứng dụng của Sb trong cuộc sống
Nguyên tố Sb (Stibium hay Antimon) có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau. Dưới đây là một số ứng dụng đáng chú ý của nguyên tố Sb:
1. Hợp chất chống cháy: Antimon trioxit (Sb2O3) và trixoantimonat (Sb2O5) được sử dụng làm hợp chất chống cháy trong các vật liệu như nhựa, cao su và vải. Chúng có khả năng ngăn chặn và giảm thiểu sự lan truyền của lửa và khí độc trong trường hợp cháy.
2. Dùng trong sản xuất hợp kim: Sb thường được sử dụng để sản xuất các loại hợp kim như hợp kim Sb-Bi (một loại chất làm nguội), hợp kim Sb-Ag (sử dụng trong các bộ điều khiển điện tử và thiết bị đo lường), và hợp kim Sb-Cu (sử dụng trong các ống nghiệm và dụng cụ y tế).
3. Ứng dụng trong pin: Sb được sử dụng trong một số loại pin, nhất là các pin chì-asen (Pb-acid) để tăng hiệu suất và tuổi thọ của pin.
4. Dược phẩm: Một số hợp chất của Sb được sử dụng làm thành phần trong thuốc trị bệnh như viêm gan, giun kim, và nhiễm trùng.
5. Chất điều chỉnh hệ thống: Antimon cũng được sử dụng trong việc điều chỉnh hệ thống và quá trình của nó trong ngành công nghiệp tổng hợp và sản xuất hóa chất.
Ngoài ra, Sb cũng được sử dụng trong các ứng dụng như mạ điện, sản xuất thủy tinh chống chói, chất kháng khuẩn, và trong ngành công nghiệp điện tử.
Những điều cần lưu ý về nguyên tố Sb
1. Nguyên tố Sb là tên viết tắt của Stinbên, có số nguyên tử là 51 trong bảng tuần hoàn.
2. Sb thuộc nhóm 15 và chu kỳ 5 của bảng tuần hoàn các nguyên tố hóa học.
3. Trong tự nhiên, Sb thường tồn tại dưới dạng các khoáng chất như stibnit (Sb2S3) và valentinit (Sb2O3).
4. Sb có màu trắng bạc và có tính chất dẫn điện và dẫn nhiệt tốt.
5. Sb là một nguyên tố chuyển tiếp, có tính chất kim loại đồng thời cũng có tính chất bất kim.
6. Stinbên không phản ứng với nước ở điều kiện thường, nhưng có thể phản ứng với axit.
7. Sb có tính chất độc hại và có thể gây hại cho sức khỏe nếu tiếp xúc với nồng độ cao.
8. Stinbên được sử dụng trong công nghiệp hóa chất và điện tử, trong việc sản xuất pin, bảo vệ cháy nổ và các hợp chất kháng khuẩn.
9. Trong y học, hợp chất của Sb (như tartarat antimon) đã được sử dụng trong việc điều trị một số bệnh như vi khuẩn tụ cầu và nhiễm trùng da.
10. Trong lĩnh vực nung chảy, Sb được sử dụng để tạo ra chất chống cháy và chất chống tác động từ môi trường.


