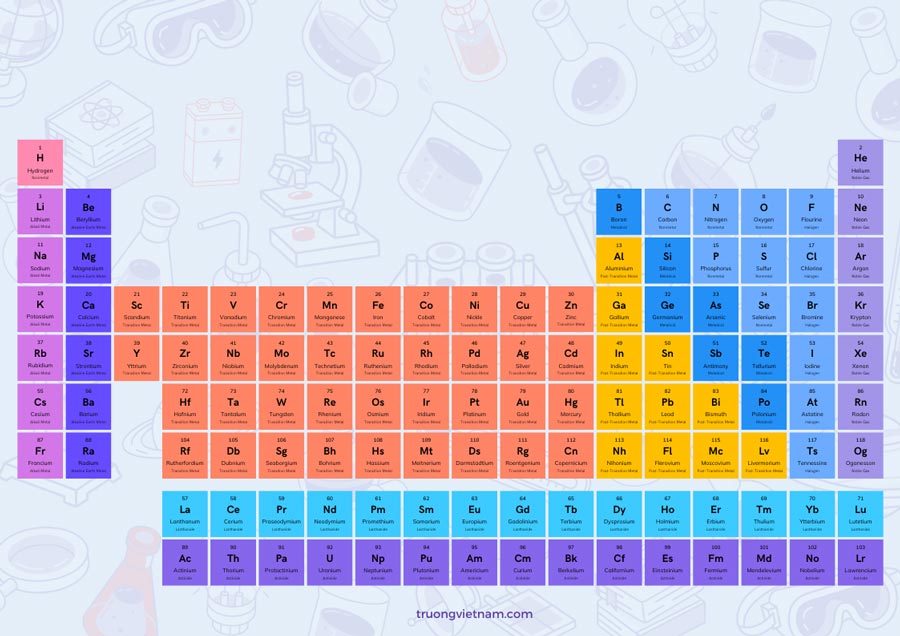
Nguyên tố Th là gì?
Nguyên tố Th trong hóa học là viết tắt của thành tử. Trong bảng tuần hoàn các nguyên tố hóa học, Th thường được sử dụng để chỉ nguyên tố Thorium, có số nguyên tử là 90 và được ký hiệu là Th. Nguyên tố Thorium là một kim loại hiếm trong mạnh nhóm actini, có ứng dụng trong các nguồn năng lượng hạt nhân.
| Ký hiệu hóa học: | Ký hiệu hóa học của nguyên tố Th là Th. |
| Tên Latin: | Nguyên tố thủy ngân trong bảng tuần hoàn có tên Latin là Hydrargyrum, được viết tắt là Hg. |
| Số hiệu nguyên tử: | Số hiệu nguyên tử của nguyên tố Th là 90. |
| Chu kỳ: | chu kỳ nguyên tử hóa học là một quy luật xếp các nguyên tố hóa học vào một bảng gọi là bảng tuần hoàn, trong đó các nguyên tố được sắp xếp theo thứ tự tăng dần của số hiệu nguyên tử. Bảng tuần hoàn hiện nay được biết đến với tên gọi là bảng tuần hoàn của Mendeleev, theo tên của nhà hóa học người Nga Dmitry Mendeleev, người đầu tiên xác định và sắp xếp các nguyên tố hóa học thành bảng này. Bảng tuần hoàn gồm 7 hàng ngang, được gọi là chu kỳ, và 18 cột dọc, được gọi là nhóm. Chu kỳ đầu tiên chỉ có 2 nguyên tố, Hidro (H) và Helium (He), trong khi các chu kỳ tiếp theo có số lượng nguyên tố tăng dần từ 8 đến 18. Khi một chu kỳ kết thúc, chu kỳ tiếp theo bắt đầu và do đó các nguyên tố trong cùng một chu kỳ thường có tính chất hóa học tương tự nhau. Các nguyên tố trong cùng một nhóm thường có cùng số electron ngoại cùng, dẫn đến các tính chất hóa học tương tự. Có tổng cộng 18 nhóm trong bảng tuần hoàn, được đánh số từ 1 đến 18. Những nguyên tố có cùng nhóm thường có cùng tính chất hóa học và thường được gọi là có cùng “nhóm)”. Ví dụ, nguyên tố trong nhóm 1 (còn gọi là nhóm kiềm) như Li (Lithium), Na (Natri) và K (Kali) đều có tính chất kim loại, reo nước mạnh và dễ phản ứng với nước. Chu kỳ nguyên tử hóa học rất quan trọng trong việc dự đoán và hiểu về các tính chất hóa học của các nguyên tố. Nó đã giúp cho việc nghiên cứu và phát triển các hợp chất hóa học, cũng như thiết kế và sản xuất các chất liệu mới. |
| Nhóm nguyên tố: | Nguyên tố Th thuộc nhóm lantan. Nhóm nguyên tố lantan là một nhóm của bảng tuần hoàn các nguyên tố hóa học, nằm ở dãy 6 (IB) và bao gồm các nguyên tố từ lantan (La) đến lutetium (Lu). Một số đặc điểm của nhóm lantan trong hóa học bao gồm: 1. Cấu trúc electron: Tất cả các nguyên tử lantan có cấu trúc electron trong hạt nhân gồm cùng một số electron là 57, tương đối ổn định. Electon thứ 4f trên lớp electron ngoại cùng tạo nên thành phần chính của cấu hình electron của nhóm nguyên tố lantan. 2. Đồng hóa trị: Tất cả các nguyên tử lantan đều có hóa trị +3. Điều này có nghĩa là các nguyên tử lantan đều mất 3 electron để hoàn thiện cấu trúc electron và trở thành ion dương. Hóa trị +3 của lantan cũng là hóa trị phổ biến nhất trong nhóm và thường đi kèm với các ion âm để tạo thành hợp chất. 3. Phản ứng giống nhau: Tất cả các nguyên tử lantan đều có tính chất hóa học tương tự nhau, do cấu trúc electron giống nhau và cùng có hóa trị +3. Điều này làm cho các nguyên tử lantan có khả năng tham gia vào các phản ứng hóa học tương tự và tạo ra các hợp chất tương đương. 4. Tính chất từ: Lớp electron ngoại cùng của các nguyên tử lantan tạo thành các orbital f, từ đó nguyên tử lantan có khả năng tạo ra từ mạnh. Các từ của lantan có thể được sử dụng trong các ứng dụng từ, như nam châm mạnh, diêm từ, lasers và cảm biến từ. Đây chỉ là một số đặc biệt cơ bản về nhóm lantan trong hóa học, còn nhiều đặc điểm khác có thể được tìm hiểu và nghiên cứu sâu hơn. |
| Khối lượng nguyên tử tương đối: | Nguyên tử tương đối của nguyên tố Th (Thori) là 232,0381. |
| Số Oxy hóa: | Số oxy hóa của nguyên tố Th (thorium) thường là +4. |
| Cấu hình electron (e): | Cấu hình electron của nguyên tố Thallium (Th) là: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p1. |
| Khối lượng riêng [g/cm3]: | Khối lượng riêng của nguyên tố Th (Thorium) là khoảng 11,72 g/cm3. |
| Trạng thái: | Trạng thái của nguyên tử Th(Thori) là chất rắn. Thori là một nguyên tố lạng trang, có màu bạc trắng trong suốt. Điểm đặc biệt của nguyên tố Th là nó là nguyên tố nặng nhất trong các nguyên tố tự nhiên và là nguyên tố có tuổi thọ hạt nhân dài nhất (khoảng 14 tỷ năm) trong tự nhiên. Bên cạnh đó, Thori cũng được sử dụng trong ngành hạt nhân, như là một nguyên liệu để sản xuất chất nhiên liệu phản ứng hạt nhân. |
Tính chất hóa học của nguyên tố Th
Nguyên tố Th (thorium) có các tính chất hóa học sau:
1. Thế điện hóa: Thorium có thế điện hóa dương cao, tức là nó có khả năng mất electron để tạo thành ion dương Th4+.
2. Hoạt động hóa học: Thorium là kim loại chuyển tiếp trong bảng tuần hoàn các nguyên tố hóa học và có khả năng tạo thành hợp chất với các nguyên tố khác. Đặc biệt, nó tạo thành hợp chất oxy, nitơ, clo và lưu huỳnh.
3. Oxy hóa: Thorium có khả năng bị oxy hóa trong môi trường không khí và tạo thành oxit thorium(IV) (ThO2).
4. Phản ứng hóa học: Thorium có thể phản ứng với nhiều axit như axit sunfuric (H2SO4), axit nitric (HNO3), axit clorhidric (HCl), tạo thành các muối thorium.
5. Phân hủy phóng xạ: Thorium-232 là một nguồn phóng xạ tự nhiên và thải ra phóng xạ alpha. Nó phân rã thành radium-228 sau một quá trình gián tiếp và sau đó phân rã thành radon-220 và các nguyên tố con trở nên ổn định hơn theo chuỗi phân rã thorium.
6. Ứng dụng: Thorium được sử dụng trong công nghiệp hạt nhân như chất nhiên liệu cho các loại reaktor hạt nhân, trong công nghệ điện hạt nhân và trong các ứng dụng quang học và vật liệu mới.

Phản ứng của kim loại với Th
Kim loại phản ứng với nguyên tử Th (thorium) để tạo thành hợp chất thorua (ThX₂), trong đó X có thể là các nguyên tố như clor, brom, iod và flo.
Ví dụ, khi kim loại phản ứng với clor, thorium sẽ tạo ra hợp chất thorua dichlorua (ThCl₂). Phản ứng có thể được biểu diễn như sau:
Th + Cl₂ -> ThCl₂
Phản ứng của phi kim với Th
Phản ứng của phi kim (không kim loại) với nguyên tố Th (thorium) phụ thuộc vào điều kiện và các tác nhân liên quan. Dưới đây là một số phản ứng tiêu biểu:
1. Phản ứng oxi hóa: Phi kim như oxi (O2) có thể oxi hóa nguyên tố Th để tạo thành oxit thorium (ThO2).
2. Phản ứng axit: Nguyên tố Th có thể phản ứng với axit mạnh như axit sunfuric (H2SO4) để tạo ra muối thorium sunfat (Th(SO4)2) và các sản phẩm phụ khác.
3. Phản ứng với halogen: Thorium có thể phản ứng với các halogen như clo (Cl2) để tạo ra halogenit thorium (ThX4, trong đó X là halogen). Ví dụ: phản ứng với clo sẽ tạo ra thorium(IV) chloride (ThCl4).
4. Phản ứng với không khí: Trên không khí, nguyên tố Th hấp thụ oxi và hình thành một lớp oxy hóa trên bề mặt của nó. Phản ứng này gần giống với phản ứng oxi hóa, tạo ra thorium dioxide (ThO2) và thorium hydroxide (Th(OH)4).
Cần lưu ý rằng phản ứng phụ thuộc vào điều kiện như nhiệt độ, áp suất và sự có mặt của các chất tác động khác. Các phản ứng đồng thời cũng tạo ra các sản phẩm phụ khác nhau.
Phản ứng của Oxit Kim loại với Th
Phản ứng giữa oxit kim loại và nguyên tử thường xảy ra khi nguyên tử có độ âm điện cao hơn so với kim loại. Trong trường hợp này, nguyên tử sẽ cướp đi một số electron từ ion kim loại để hình thành ion thậm chí khi Oxit làm mất cấu trúc của các ion kim loại.
Phản ứng Oxi với Th
Phản ứng oxi với nguyên tố thường được gọi là oxi hoá, trong đó oxi nhận điện tử từ nguyên tố khác. Tuy nhiên, tôi không chắc rằng “nguyên tố Th” bạn đề cập là nguyên tố nào chính xác. Bạn có thể cung cấp thêm thông tin về nguyên tố này không?
Tính chất vật lý của Th
Nguyên tố Th (Thorium) là một nguyên tố kim loại phóng xạ, có trong dạng tự nhiên và được tìm thấy chủ yếu trong quặng thorit và monazit. Dưới dạng ở nhiệt độ phòng, thorium là một kim loại màu bạc, cứng và malleable. Nó có độ bền hóa học cao và không bị ảnh hưởng bởi không khí, nước hay axit, tuy nhiên, nó có thể oxi hóa khi tiếp xúc với khí nitric và axit sulfuric đậm đặc. Nhiệt độ nóng chảy của thorium là khoảng 1750°C, và nhiệt độ sôi cực cao lên đến hơn 4.800°C.
Thorium có khả năng phát xạ tự nhiên, với một chu kỳ bán rã lâu dài. Đặc điểm quan trọng nhất của thorium là khả năng phân rã alpha, tức là phát ra hạt nhân heli khi phân rã. Do đó, thorium có thể được sử dụng trong lĩnh vực năng lượng hạt nhân như chất nhiên liệu trong các lò phản ứng hạt nhân.
Tuy nhiên, thorium cũng có các tính chất độc hại khi nó bị tiếp xúc hoặc sử dụng không an toàn. Tiếp xúc với bụi hoặc hơi thorium có thể gây ra vấn đề sức khỏe nghiêm trọng, như viêm phổi, ung thư phổi và nhiều bệnh khác. Do đó, việc làm việc với thorium cần tuân thủ các quy tắc an toàn nghiêm ngặt.

Điều chế Th trong phòng thí nghiệm
Để điều chế nguyên tố Th trong phòng thí nghiệm, ta cần thu được mẫu chất Thorium (Th) và tiến hành quá trình tinh chế và phân lập nguyên tố này. Dưới đây là một quy trình thường được sử dụng để điều chế nguyên tố Th:
1. Chuẩn bị mẫu chất Thorium (Th): Mẫu chất Th có thể được thu được từ mỏ quặng Thorium hoặc từ các chất phế thải của các quá trình khai thác và chế biến khoáng sản. Mẫu chất này thường phải được tinh chế để loại bỏ các tạp chất khác và cung cấp nguyên tố Th tinh khiết.
2. Tiến hành quá trình gia nhiệt: Mẫu chất Th được đặt trong một lò gia nhiệt và được gia nhiệt ở nhiệt độ cao để dễ dàng tách khỏi các chất tạp. Quá trình gia nhiệt này thường được thực hiện trong một môi trường không khí hoặc trong một môi trường chứa khí thế nung là argon (Ar) để ngăn ngừa sự tác động của oxi hóa.
3. Quá trình phân lập: Sau khi qua gia nhiệt, mẫu chất Th sẽ được tách khỏi các tạp chất khác. Có thể sử dụng các phương pháp phân tách như phương pháp điện phân, phương pháp chiết tách hoặc phương pháp trao đổi ion để tách riêng nguyên tố Th tinh khiết.
4. Quá trình tinh chế cuối cùng: Sau khi được phân lập, nguyên tố Th tiếp tục trải qua các bước tinh chế cuối cùng để đạt đến mức độ tinh khiết mong muốn. Các phương pháp tinh chế bao gồm phe nước (hoặc các dung dịch hóa học khác), tuyển chọn từ và các phương pháp tinh chế khác.
Quá trình điều chế nguyên tố Th trong phòng thí nghiệm cần tuân thủ các biện pháp an toàn và quy định về xử lý chất thải hóa học để đảm bảo sự an toàn cho nhân viên và môi trường.
Điều chế Th trong công nghiệp
Nguyên tố Th (Thori) là một trong những nguyên tố hiếm có trong tự nhiên và không có ứng dụng rộng rãi trong công nghiệp hiện đại. Tuy nhiên, trong quá khứ, nguyên tố Th đã được sử dụng trong một số công nghiệp nhất định.
Một trong những ứng dụng chính của nguyên tố Th là trong ngành sản xuất kính camera, đặc biệt là máy ảnh. Th có khả năng hấp thụ các tia phụ ở dải tia cực ngắn và tia X, giúp cải thiện chất lượng hình ảnh được ghi lại thông qua việc giảm nhiễu và tăng độ phân giải.
Ngoài ra, Th cũng được sử dụng trong chế tạo các bộ phận điện tử như các bóng đèn bức xạ mềm, cát điện tử và các bộ phận cảm biến trong các công nghiệp như y tế và hạt nhân. Tuy nhiên, do tính chất phóng xạ và độc hại của Th, việc sử dụng Th đã bị hạn chế và thay thế bằng các vật liệu khác an toàn hơn.
Hiện nay, công nghệ chế tạo nguyên tố Th từ các nguồn tự nhiên hoặc phản ứng hạt nhân đã được phát triển đáng kể, nhưng sử dụng thực tế của nó trong công nghiệp vẫn rất ít.
Ứng dụng của Th trong cuộc sống
Nguyên tố Th (thorium) có nhiều ứng dụng khác nhau trong các lĩnh vực sau:
1. Nhiên liệu hạt nhân: Thorium có thể được sử dụng làm nhiên liệu trong lò phản ứng hạt nhân thorium (thorium-based nuclear reactors). Việc sử dụng nguyên tố Th trong lĩnh vực điện hạt nhân có thể giúp giảm rủi ro về các vấn đề an toàn và xử lý chất thải hạt nhân.
2. Lĩnh vực y tế: Một số isotop của thorium, chẳng hạn như thorium-228, có thể được sử dụng để điều trị ung thư. Hợp chất chứa thorium cũng có thể được sử dụng để tạo ảnh hình ảnh y tế.
3. Công nghệ hàn: Thorium có thể được sử dụng để làm phụ gia trong các hợp kim hàn. Nó có khả năng làm mát và nâng cao hiệu suất của quá trình hàn.
4. Thủy tinh chống tia cực tím: Thorium có khả năng tăng cường tính chất chống tia cực tím của thủy tinh. Do đó, nó được sử dụng để sản xuất kính chống tia cực tím cho các ứng dụng trong mắt kính, kính mát và các thiết bị khác.
5. Phân tích đồng vị: Với sự biến đổi isotop của thorium, nguyên tố này có thể được sử dụng trong phân tích đồng vị để nghiên cứu và theo dõi quá trình hoá học và sinh học trong các hệ thống sống.
Trên đây chỉ là một số ứng dụng của nguyên tố Th. Nguyên tố này còn có thể có những ứng dụng khác tùy thuộc vào nghiên cứu và phát triển khoa học kỹ thuật.

Những điều cần lưu ý về nguyên tố Th
1. Tên gọi: Nguyên tố thủy ngân có tên gọi tiếng Anh là Mercury và ký hiệu là Hg.
2. Tính chất vật lý:
– Thủy ngân là kim loại màu trắng bạc và có độ bóng cao.
– Độ mềm và nhờn của nó giúp dễ dàng tạo thành hình bằng cách dùng cánh trên tay.
– Thủy ngân có điểm nóng chảy thấp là -38,83 độ C và điểm sôi ở 356,7 độ C.
– Là kim loại duy nhất ở dạng lỏng ở điều kiện thường.
3. Tính chất hóa học:
– Thủy ngân không bị oxi hóa nên không bị ăn mòn.
– Tuy nhiên, nó có thể tạo ra các hợp chất hóa học độc như thủy ngân đen (HgS) và thủy ngân kẽm (ZnHg).
– Thủy ngân cũng có khả năng hòa tan kim loại như vàng, bạc và thiếc để tạo ra hợp kim.
4. Ứng dụng:
– Thủy ngân được sử dụng trong nhiều lĩnh vực như y tế (trong nhiệt kế, nước cọ rửa, những quá trình tiệt trùng..), công nghiệp (trong quá trình sản xuất PVC, lưu huỳnh nhân tạo, bóng trung tính…), và trong đèn huỳnh quang.
– Tuy nhiên, do tính độc hại của nó, việc sử dụng thủy ngân đã bị hạn chế và được thay thế bằng các chất không gây hại cho môi trường và con người.